研究内容
カチオン性イリジウム触媒を用いた炭素-水素結合活性化反応
遷移金属触媒を用いた不活性な炭素-水素結合の直截的な官能基化、すなわち炭素-水素結合活性化反応は原子効率の向上や反応工程数の低減の点から、優れた手法として注目されている。我々は、カチオン性ロジウム触媒を用いたジインとカルボニル化合物とのヘテロ[2+2+2]付加環化反応1)の研究過程で、カルボニル化合物としてアリールケトンやエノンを用いると、環化を伴ったヒドロアリール化、ある いはヒドロビニル化が進行し、単環性1,3-ジエンが得られることを見出した。重水素を用いたラベル実験、ジインに替えモノインを用いる対照実験、付加環化反応による類似不斉反応との比較実験などの反応機構に関する考察から、本反応はカルボニルのβ-位のC-H結合のロジウム錯体による 活性化(切断)を起点とする反応である考えた。2)
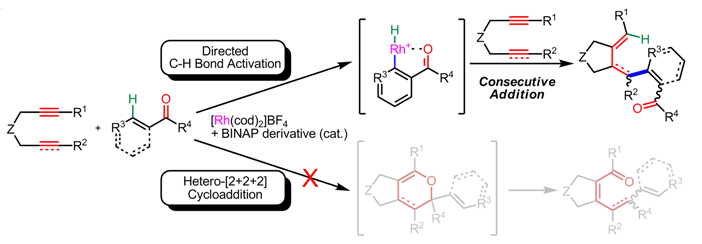
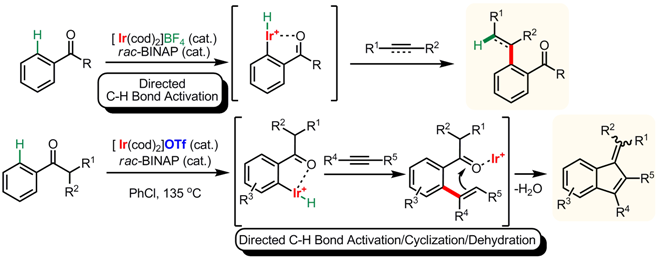
そこで我々はより単純な反応系として、アリールケトンとアルキンを用いたオルト位sp2C-H結合のアルケニル化を検討した。その結果、カチオン性ロジウム錯体よりカチオン性イリジウム錯体が より高い触媒活性を示すことがわかった。3) また、適切なカウンターアニオンを適用することでルイス酸機能も有する二機能性触媒として作用することも見出した。 カウンターアニオンとしてOTf-を有するカチオン性イリジウム触媒を用いるとC-H結合官能基化に続き、環化、脱水反応がワンポットで進行し、ベンゾフルベン誘導体が得られた。4)
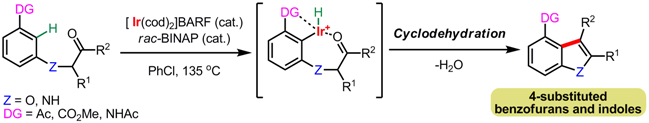
我々はカチオン性イリジウム触媒のこの特性を活かし、C-H結合活性化を経由した分子内反応によるベンゾフランおよびインドール合成法を開発した。本反応はすなわち、アリールケトンのメタ位にエーテル、 もしくはアミン結合した側鎖を導入し、その末端にカルボニル基を持つアリールケトン誘導体を反応基質として用いることで、イリジウム錯体がオルト位のC-H結合切断後、メタ位に置換した側鎖上のカルボニル基に1,2-付加 し、4位置換ベンゾフランおよびインドールが得られる。5)
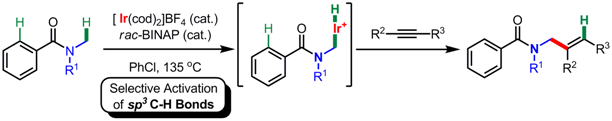
また、我々はアリールケトンに替え、アリールアミドの炭素-水素結合活性化反応も検討した。カチオン性イリジウム触媒を用いて、アリールアミドとアルキンを反応させたところ、 予想されるオルト位アルケニル化体ではなく、多置換アリルアミドが得られることを見出した。重水素でラベル化したN-メチルピロリドンを用いた検討から、本反応はカチオン性イリジウム触媒によるsp3C-H結合の切断を経由した アルキンの付加であることがわかった。一般に、sp3C-H結合はC-H結合活性化において、sp2C-H結合より不活性であるため、興味深い例といえる。6)
参考文献
- Tsuchikama, K.; Yoshinami, Y.; Shibata, T. Synlett 2007, 1395-1398.
- Tsuchikama, K.; Kuwata, Y.; Tahara, Y.; Yoshinami, Y.; Shibata, T. Org. Lett. 2007, 9, 3097-3099. Highlighted in Synfacts 2007, 1071.
- Tsuchikama, K.; Kasagawa, M.; Hashimoto, Y.; Endo, K.; Shibata, T. J. Organomet. Chem. 2008, 693, 3939-3942.
- Tsuchikama, K.; Kasagawa, M.; Endo, K.; Shibata, T. Synlett 2010, 97-100. Highlighted in Synfacts 2010, 294.
- Tsuchikama, K.; Hashimoto, Y.; Endo, K.; Shibata, T. Adv. Synth. Catal. 2009, 351, 2850-2854. Highlighted in Synfacts 2010, 153.
- Tsuchikama, K.; Kasagawa, M.; Endo, K.; Shibata, T. Org. Lett. 2009, 11, 1821-1823. Highlighted in Synfacts 2009, 782.